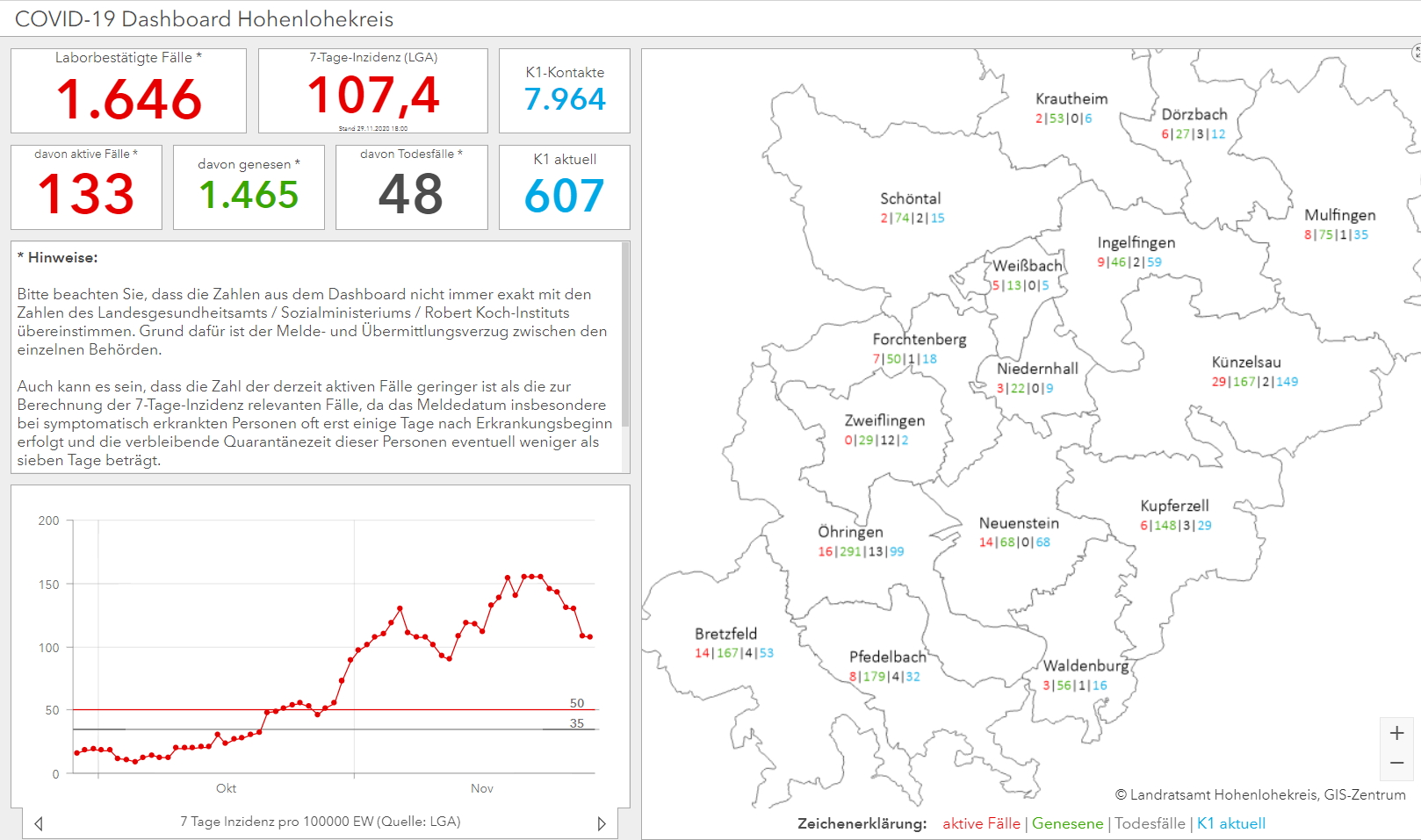
Die Heilsbringer: Pharmafirmen in der Impfstoff-Rallye
Auf den Impfstoffen gegen das Corona-Virus ruhen zurzeit weltweit alle Hoffnungen. Schon im Dezember könnte es mit den Impfungen losgehen, versprechen die beteiligten Firmen. Zurzeit überbieten sie sich beinahe in Erfolgsmeldungen. Um das Verfahren noch zu beschleunigen hat die Bundesregierung sogar ein Sonderprogramm zur „Beschleunigung von Forschung und Entwicklung dringend benötigter Impfstoffe gegen SARS-CoV-2“ eingerichtet mit einem Volumen von 750 Millionen Euro (Homepage des Bundesministeriums für Bildung und Forschung https://www.bmbf.de/foerderungen/bekanntmachung-3035.html). Und schon wird gestritten – über die Verteilung der Impfstoffe und welcher Personenkreis zuerst das Vergnügen haben wird. Doch wie wirken diese Impfstoffe überhaupt und wie sicher können sie sein angesichts der Kürze der Zeit, mit der sie auf den Markt kommen sollen? GSCHWÄTZ hat sich die beiden Kandidaten aus Deutschland der Firmen Biontech und CureVac genauer angeschaut.
Mehrere Testphasen vor der Zulassung
Zunächst einmal: Bevor ein Impfstoff in Deutschland eine Zulassung erhält, muss er mehrere Testphasen durchlaufen. So schreibt das Paul-Ehrlich-Institut, das in Deutschland für die Genehmigung klinischer Prüfungen sowie die Bewertung und Zulassung von Impfstoffen zuständig ist (https://www.pei.de/DE/home/home-node.html) auf seiner Homepage: „In Zellkulturen (z.B. mit Immunzellen des Menschen) und in Tierversuchen werden Wirksamkeit und Verträglichkeit des Impfstoffkandidaten getestet. Erst nach umfangreichen Untersuchungen und dem Nachweis, dass der Impfstoff in guter Qualität verlässlich hergestellt werden kann, wird er in klinischen Prüfungen der Phase I bis Phase III an freiwilligen Studienteilnehmenden nach deren Aufklärung erprobt. Liegen alle Ergebnisse der präklinischen und klinischen Prüfungen vor, kann ein Zulassungsantrag gestellt werden. Für Europa wird das Zulassungsverfahren für COVID-19-Impfstoffe durch die Europäische Arzneimittelagentur EMA (European Medicines Agency) koordiniert (https://www.pei.de/DE/newsroom/dossier/coronavirus/coronavirus-inhalt.html?nn=169730&cms_pos=1).
Immunreaktion ohne Infektion
In Deutschland sind zurzeit zwei Firmen vorne mit dabei im Impfstoff-Rennen: die Mainzer Firma Biontech, die mit dem US-Pharmariesen Pfizer zusammenarbeitet. Deren Impfstoff hat bereits eine Zulassung in Großbritannien erhalten, wie das Unternehmen am Mittwoch, den 02. Dezember 2020, verkündete (https://investors.biontech.de/de/news-releases/news-release-details/pfizer-und-biontech-erhalten-weltweit-erste-zulassung-fuer-covid). Weit die Nase vorne hat auch das Unternehmen CureVac aus Tübingen, an dem im Frühjahr auch US-Präsident Donald Trump Interesse gezeigt haben soll. An weiteren Impfstoffen arbeiten der britische Pharmakonzern AstraZeneca mit der Universität Oxford sowie die US-Firma Moderna. Die Impfstoffe haben ein gemeinsames Ziel: Durch die Impfung soll eine Immunreaktion hervorgerufen werden, ohne dass eine Infektion stattgefunden hat, und durch die das Immunsystem dann Antigene bildet.
„Eine Integration vonRNA in DNA ist unter anderem aufgrund der unterschiedlichen chemischen Struktur nicht möglich“
Die mRNA-Impfstoffe von Biontech und CureVac enthalten genetische Informationen des Erregers. Mit deren Hilfe sollen die Körperzellen der geimpften Personen Oberflächenproteine des Corona-Virus entwickeln. Gegen diese wiederum bildet das Immunsystem die Antikörper. Vorteile der mRNA-Impfstoffe: Sie haben eine einfache Struktur und bieten die Möglichkeit, in wenigen Wochen viele Millionen Impfdosen herzustellen. Laut Paul-Ehrlich-Insitut besteht auch nicht die „Gefahr einer Integration von mRNA in das humane Genom. Beim Menschen befindet sich das Genom in Form von DNA im Zellkern. Eine Integration vonRNA in DNA ist unter anderem aufgrund der unterschiedlichen chemischen Struktur nicht möglich.“ Das Institut habe auch noch keinen Hinweis darauf gefunden, „dass die von den Körperzellen nach der Impfung aufgenommen mRNA in DNA umgeschrieben wird“ (https://www.pei.de/DE/newsroom/dossier/coronavirus/coronavirus-inhalt.html?nn=169730&cms_pos=2). Übrigens schreibt sich CureVac zugute, „das Potenzial der mRNA zur Behandlung von Krankheiten und zur Herstellung von Impfstoffen entdeckt“ zu haben: Unternehmensgründer, Dr. Ingmar Hoerr, habe als Doktorand herausgefunden, „dass das instabile Biomolekül mRNA bei direkter Verabreichung ins Gewebe als therapeutischer Impf- oder Wirkstoff eingesetzt werden kann, wenn es zuvor optimiert wird“. CureVac sei das weltweit erste Unternehmen, „das mRNA erfolgreich für medizinische Zwecke einsetzt“ (https://www.curevac.com/ueber-uns/).
„Wir werden unterschiedliche Impfstoffprodukte benötigen, um den weltweit hohen Bedarf decken zu können“
Andere Impfstoffe sind die sogenannten Peptid-Impfstoffe. Diese stimulieren „die T-Zell-Antwort, die Zellen des Immunsystems erkennen und SARS-CoV-2-infizierte Zellen zerstören“ heißt es auf der Homepage des Paul-Ehrlich-Institus. An einem solche arbeitet die Universität Türbingen. Für ihren Impfstoffkandidaten hat das Paul-Ehrlich-Institut Ende November die erste klinische Prüfung der Phase I eines Peptid-Impfstoffs gegen COVID-19 in Deutschland genehmigt. „Der Peptid-Impfstoff ergänzt das Portfolio der COVID-19-Impfstoffplattformen um einen weiteren vielversprechenden Ansatz“, so Professor Klaus Cichutek, Präsident des Paul-Ehrlich-Instituts, auf der Internetseite. „Diese Vielfalt ist wichtig, denn wir werden unterschiedliche Impfstoffprodukte benötigen, um den weltweit hohen Bedarf decken zu können.“ (https://www.pei.de/DE/newsroom/pm/jahr/2020/25-klinische-pruefung-uni-thuebingen-covid-19-impfstoff.html?nn=172068).
Wirksamkeit von 95 Prozent
Biontech verspricht bei seinem Impfstoff eine Wirksamkeit von 95 Prozent: „Die Entscheidung der Medicines & Healthcare Products Regulatory Agency (MHRA) des Vereinigten Königreiches basiert auf einer rollierenden Einreichung, die Daten aus der Phase-3-Studie enthält, welche einen 95-%igen Impfschutz (p<0.0001) in Probanden ohne vorherige SARS-CoV-2-Infektion (erstes Hauptziel der Studie) zeigen. Auch in Probanden mit oder ohne vorheriger SARS-CoV-2-Infektion konnte ein Impfschutz erreicht werden (zweites Hauptziel der Studie). In beiden Fällen wurde der Impfschutz sieben Tage nach der zweiten Dosis erzielt.“ (https://investors.biontech.de/de/news-releases/news-release-details/pfizer-und-biontech-erhalten-weltweit-erste-zulassung-fuer-covid). Um einen wirksamen Schutz zu erreichen, soll der Biontech-Impfstoff zweimal innerhalb von drei Wochen verabreicht werden. Bereits 28 Tage nach der ersten Impfung und sieben Tage nach der zweiten soll seine Wirksamkeit feststellbar sein, wie das Unternehmen auf Twitter mitteilte (https://twitter.com/BioNTech_Group). Der größte Nachteil des Biontech-Impfstoffs allerdings ist, dass er bei -70 Grad gelagert werden muss. Bei normalen Kühlschranktemperaturen ist er nur fünf Tage lang haltbar. Außerdem soll noch unklar sein, ob er vor schwereren Verläufen schützt, denn während der Testphase soll ein Geimpfter schwer an Covid-19 erkrankt sein.
Drei Monate Haltbarkeit bei fünf Grad Celsius
Das Unternehmen CureVac schreibt über seinen Impfstoff auf der Firmen-Homepage „Die zuvor bekanntgegebenen Interimsdaten zeigten, dass CVnCoV in allen geprüften Dosisstufen zwischen 2 und 12 Mikrogramm gut verträglich ist und hohe bindende und neutralisierende Antikörperlevel induziert. Zudem wurden Anzeichen einer T-Zellen-Aktivierung festgestellt. Die Qualität der Immunantwort entspricht der bei genesenen COVID-19-Patienten beobachteten Immunantwort und ist vergleichbar mit einer natürlichen COVID-19-Ansteckung.“ (https://www.curevac.com/2020/11/10/curevac-veroeffentlicht-detaillierte-interimsdaten-der-phase-1-studie-seines-covid-19-impfstoffkandidaten-cvncov/). Für die Produktion seines Impfstoffs hat CureVac eine Vereinbarung mit der Wacker Chemie AG unterzeichnet. Am Wacker-Standort in Amsterdam können laut Homepage „pro Jahr mehr als 100 Millionen Dosen des Impfstoffes von CureVac hergestellt werden. Der Standort bietet Erweiterungsoptionen, sodass zukünftig auch ein steigender Bedarf gedeckt werden kann“ (https://www.curevac.com/2020/11/23/curevac-und-wacker-unterzeichnen-vertrag-zur-produktion-des-covid-19-impfstoffkandidaten-cvncov-gemeinsame-pressemitteilung/). Eine großvolumige Produktionsanlage wird außerdem am CureVac-Standort in Tübingen aufgebaut. Der Impfstoffkandidat von CureVac soll bereits bei einer Kühlschranktemperatur von fünf Grad Celsius „mindestens drei Monate lang“, bei Raumtemperatur „bis zu 24 Stunden als gebrauchsfertiger Impfstoff stabil bleiben“ (https://www.curevac.com/2020/11/12/curevacs-covid-19-impfstoffkandidat-cvncov-fuer-logistik-bei-kuehlschranktemperatur-geeignet/). Noch in diesem Jahr soll für den Tübinger Impfstoff die letzte klinische Phase mit über 35.000 Teilnehmern in Europa und Südamerika starten. Mit einer Zulassung rechnet CureVac im Frühjahr oder Sommer 2021.
Text: Sonja Bossert